不过你知道吗?常见的显微镜观察方法就有七种之多(材料应用五种),下面就来给大伙儿讲讲各个方法的不同在于哪里,我们应该如何取舍。
明场(BF)
明场成像是最常见的显微镜观察方式,也是观察生物样品和材料样品最常用的观察方式。显微镜下你第一次看到的明场图像是什么?应该是生物课上透射光明场下的紫色洋葱表皮细胞吧!
生物研究中经常使用的免疫组化染色也是明场成像,根据标记方式不同样本会呈现不同颜色,也可利用抗体标记或染料显色来区分不同组分。
下图HE中细胞核被标记为蓝色,胞浆则被染色成粉红色。
▲HE染色和TMA标本中的DAB染色
这个方法简单有效,成本低。但是由于标记的成分数量有限,致使应用范围不广,对比也不太明显,无法判断阳性结果。
观察不透明的材料样品,反射光明场是使用最多的观察方式。光源直接照射到样品表面,表面的结构对照射光有不同程度的反射和吸收,图像的亮暗就反映样品表面的粗糙度和吸光情况。
下图是反射光明场观察方式的结构和金属纯铝明场下的图像,借助明场图像可以清晰的获取纯铝晶粒的大小和形态。
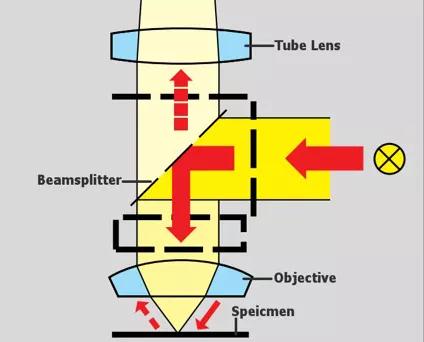

暗场(DF)
暗场成像与明场成像相对应,顾名思义,人不会直接观察到照明光线,而是光线斜射到标本的表面,根据丁道尔(Tyndall)现象,微粒对斜射光进行反射或衍射,增大了人眼可见性,我们才能够观察到极其微小的物体。
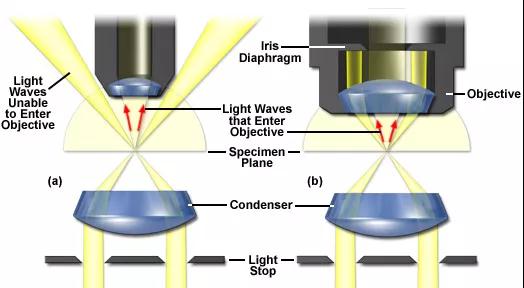
▲透射暗场成像光路原理▲透射暗场成像光路原理
那么如何实现暗场成像呢?透过显微镜剖面图,我们可以看到,聚光镜以高度角将一个光锥对准标本,这样部分光线就不会直接进入物镜。通过标本的光被光学不连续物(如细胞膜、细胞核和内部的细胞器)衍射、反射和折射,再次进入物镜,然后该样品就可以被看作是在黑色背景上的一个明亮的物体。
蔡司君通过几张图片,带大家见识一下暗场下的微观世界。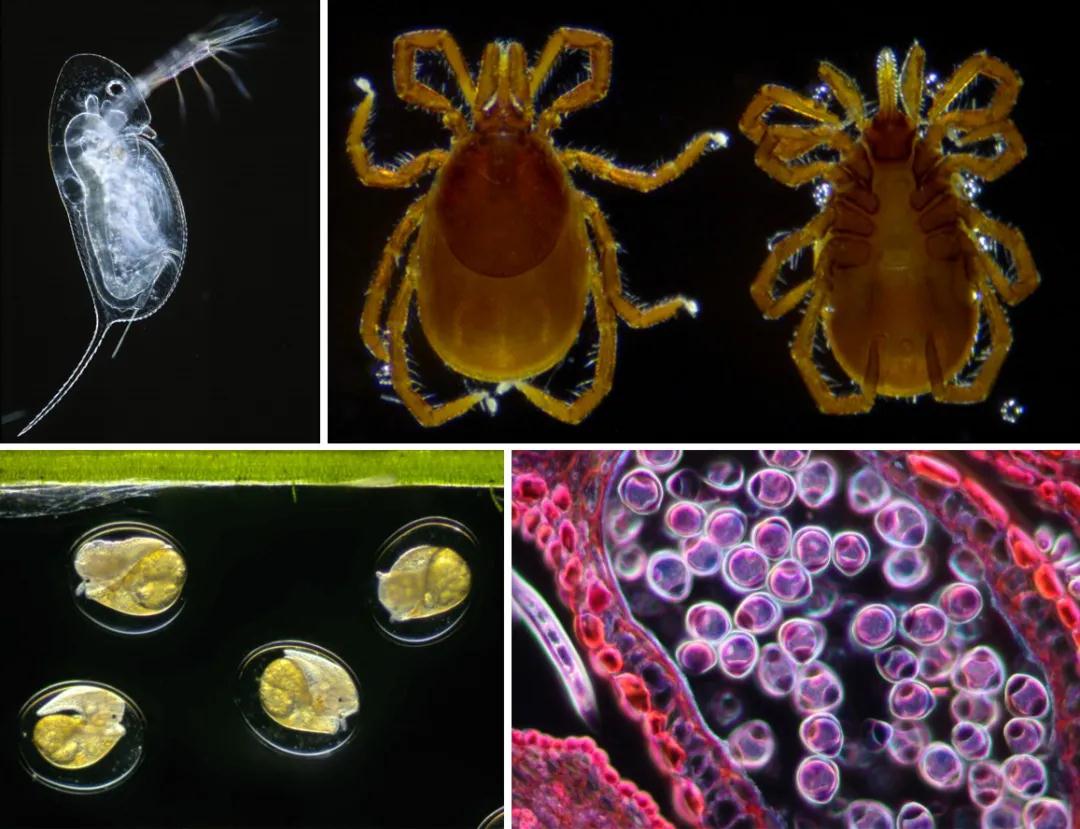
▲透射暗场观察的标本图像:水蚤,寄生虫,水蜗牛,花粉粒
总的来讲,暗场适合观察微小粒子、细菌形态、细菌记数、透明标本等,能够看到标本的细微结构。
不幸的是,物体散射的光会影响成像,从而降低对比度、模糊标本细节。同时,标本中的灰尘和碎片也对生成的图像有影响。
此外,较薄的贴壁细胞通常信号很弱,而较厚的植物和动物组织会将过多的光线重新定向到物镜内,这样将降低成像的对比度,因此暗场成像对标本的要求较高。
观察材料样品的暗场结构跟生物的有点不一样(参看左下图)。反射光暗场能够反映样品表面的超微小结构,能够观察到小至0.004um的结构。但由于微小结构对于光散射或衍射的原因,暗场下并不能够进行准确的测量,所以暗场仅适合观察,用于一些超微小结构和缺陷的定位。当然,反射光暗场也有另外一个小用途,可以获取透明或半透明材料的颜色,如PCB板的绿油,铁锈的颜色等等。


相差也是一种很常见的观察方式,用来进行活细胞成像。由于细胞在明场下轮廓不清,虽然可以观察到,但其边界或内部结构无法分辨清楚。
相差利用光程差(相位)这种人眼无法区分的技巧,光通过不同厚度标本时的光程差转变为人眼可以观察到的明暗变化,从而对标本的结构有了区分。
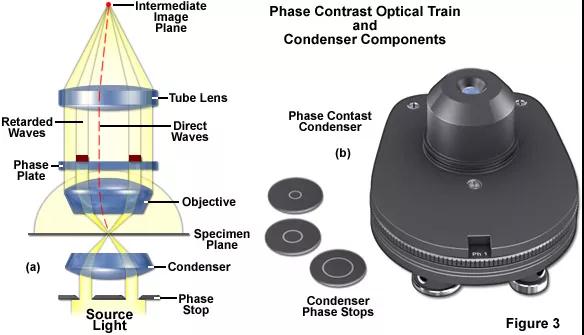
▲相差观察原理
透过原理图,我们不难发现相差成像的关键在于相差环的匹配,聚光镜中必须和相差物镜的相差环匹配。当观察或成像培养的活细胞时,相差是一种很好的增强对比度的方法,但通常会导致边缘特征轮廓周围出现光晕,而这些光晕是光学伪影,会降低边界细节的可见性。
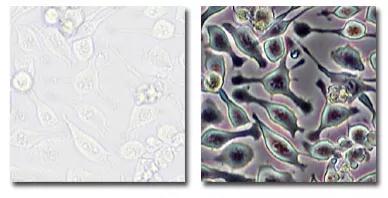
▲明场和相差观察下的细胞
另一方面,该方法对厚标本并不有用,因为一旦远离焦面,相位就会发生变化,这会扭曲图像细节。此外,漂浮的碎片和其他失焦的物体会干扰对贴壁细胞的成像。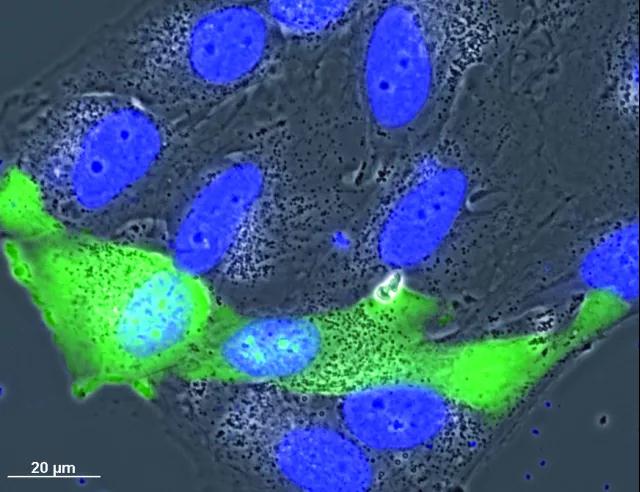
▲相差观察和荧光成像叠加
偏光(POL)
偏光显微镜具有很高的灵敏度,可用于针对各种各向异性样品的定性和定量研究。定性偏振光显微镜在实践中非常流行,然而偏振光显微镜的定量方面,主要应用于晶体学,矿物学、地质学和化学领域。
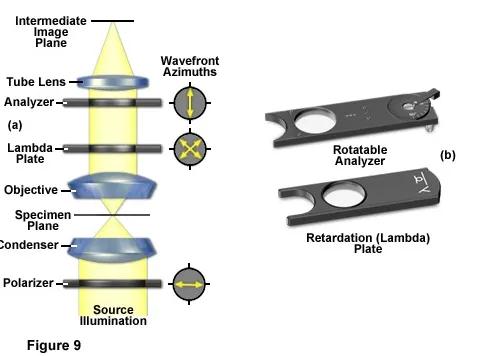
▲偏光显微镜的原理
偏振光显微镜是通过在聚光镜之前和物镜之后插入交叉偏振元件实现的。细胞内具有双折射特性的组分会旋转光的偏振平面,在深色背景上显得明亮。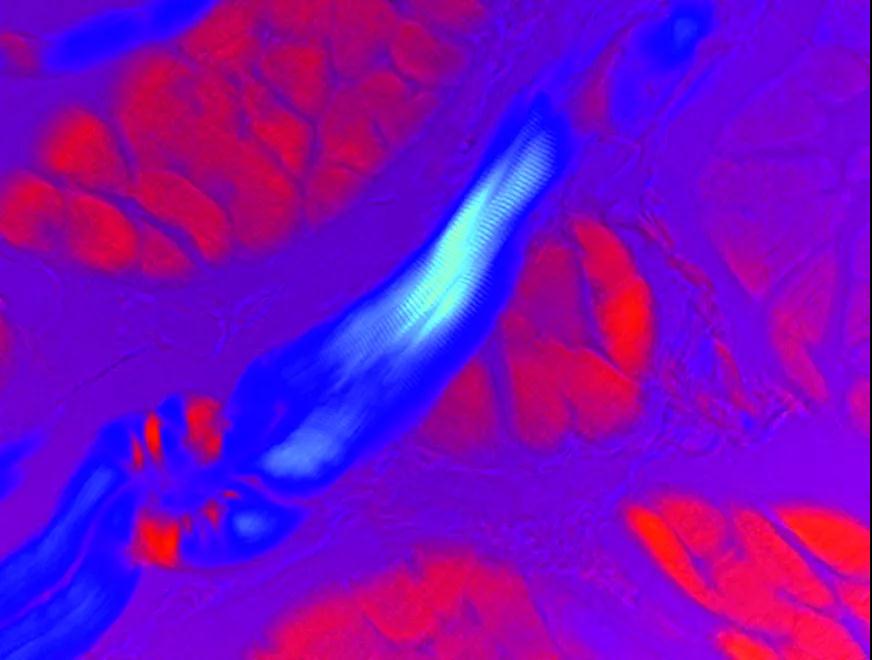
▲小鼠在偏光下可以看到不同的肌纤维排列
在过去的几年里,高灵敏度偏振光显微镜取得了稳定的进展,这使得生物学家能够检测各向异性亚细胞组合的双折射特性。例如骨骼、牙齿、胆固醇、神经纤维、肿瘤细胞、横纹肌和毛发等。
对于不透明的材料样品也可进行偏光观察,但需要反射光偏光模式,以此来分析材料的双折射性,甚至结合特殊的制样也可区分材料结晶颗粒的晶体取向。

▲反射光偏光结构示意
微分干涉(DIC)
微分干涉(DIC)是七种观察方式中最复杂的一种。光路中不仅包括偏光组件,还要包括一组特制棱镜,以放大样品厚度梯度和折射率的微小差异。例如,由于细胞的水相和脂质相之间的折射率差异,脂质双层可以在DIC中产生出色的对比度。
▲微分干涉光路原理
此外,贴壁相对平坦的哺乳动物和植物的细胞,包括细胞质膜、细胞核、液泡、线粒体和压力纤维,这些细胞边界通常有显著的梯度,很容易进行DIC成像。
在植物组织中,双折射细胞壁虽在一定程度上降低DIC的对比度,但依旧能显示表皮细胞中的核膜、液泡膜、一些线粒体、叶绿体和凝聚的染色体。与相差相比,DIC的成像效果能够避免细胞边缘的光晕。
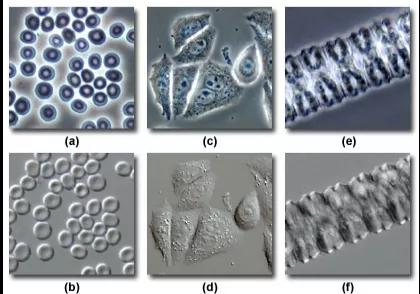
▲相差成像(a,c,e)和DIC成像(b,d,f)
微分干涉成像使样品出现一种立体感,效果更加直观,但其光路配件复杂,调节难度大。由于微分干涉是基于偏振光原理,高双折射样品或嵌入双折射材料的样品不适合微分干涉观察。
例如,微分干涉不能用于观察塑料皿内的样品,但是塑料皿适合细胞培养,可以通过蔡司特有的PlasDIC的方法,在塑料皿中进行活细胞微分干涉观察。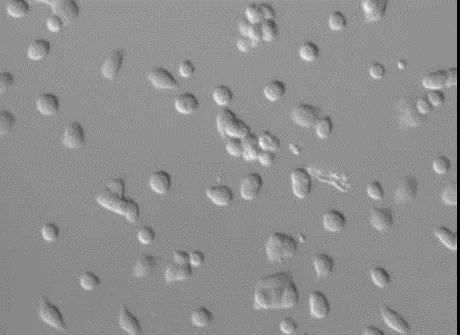
▲PlasDIC成像效果
对于材料样品来讲,微分干涉(DIC)观察方式也越来越受重视和欢迎。但是对于那些有多个方向结构的材料,DIC已经满足不了观察需求,蔡司的圆微分干涉由于把线偏振光换成圆偏振光,能够一次对样品上360度取向的结构进行成像,避免了繁琐的样品旋转。
▲反射光C-DIC结构示意
霍夫曼调制相差(HMC)
霍夫曼调制相差(HMC)利用斜射光照射到标本产生折射、衍射,光线通过物镜光密度梯度调节器产生不同阴影,从而使透明标本表面产生明暗差异,增加观察对比度。
霍夫曼调制相差不会因在光路中使用双折射材料而受到阻碍,因此该技术对于检查由聚合材料制成的容器中的样本更为有用。
而它不利的一面是,HMC会产生许多光学伪像,使该方法用于在玻璃盖玻片上进行贴壁细胞成像时比相差或DIC效果差。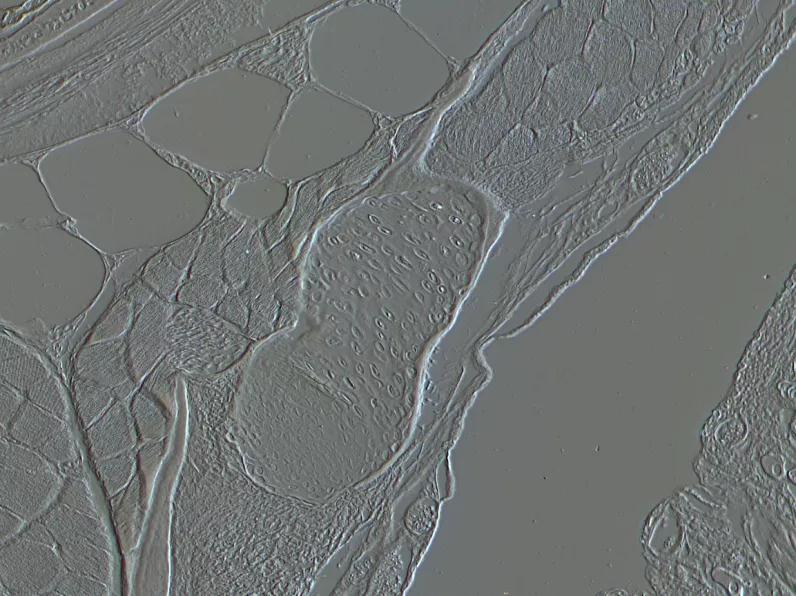
▲HMC观察鱼胚胎
这里蔡司君补充一点,还有一种新开发的观察技术,可看作相差与倾斜单边照明的结合(类似于HMC),用于检查培养容器中的活细胞。
当斜射光照射到标本产生折射、衍射,通过物镜相衬板产生不同阴影,从而使透明标本表面产生明暗差异,增加观察对比度。
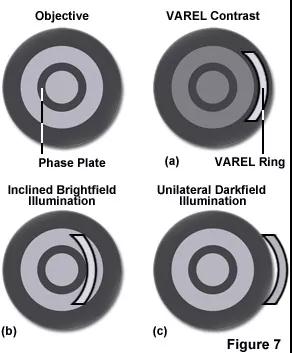
▲VAREL斜照明成像原理
07荧光成像(FL)



